



Рассмотрим ответы на Параграф 17 из учебника по химии для 9 класса Кузнецовой
Глава 5. Галогены.
§17. Строение атомов галогенов. Галогены – простые вещества.
Вопрос в начале параграфа
Назовите элементы, образующие семейство галогенов. Дайте характеристику семейству галогенов.
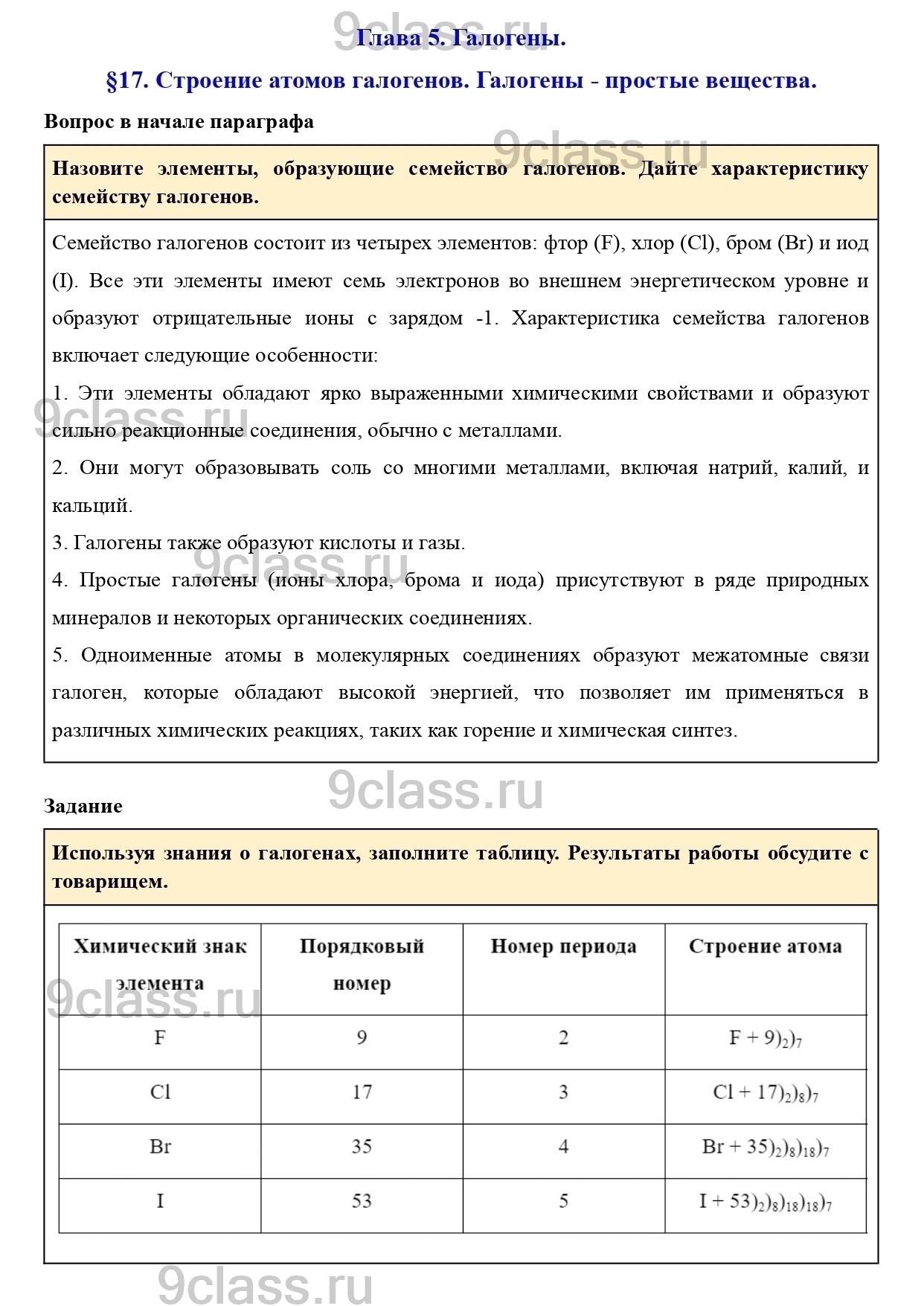
Задание
Используя знания о галогенах, заполните таблицу. Результаты работы обсудите с товарищем.
Запишите формулы молекул галогенов. Определите вид химической связи в молекулах.
Лабораторный опыт
1. В пробирку со свежеприготовленной хлорной водой опустите синюю лакмусовую бумажку и предварительно окрашенную фиолетовыми чернилами хлопчатобумажную тряпочку. Наблюдайте, что произойдет. Сделайте вывод.
2. Прилейте к растворам бромида и иодида калия хлорную воду, а к раствору иодида калия – бромную воду. Что наблюдаете? Как обнаруживаются свободный бром и иод?
Вопросы в конце параграфа
1. Напишите химические формулы веществ: фтора, фтороводорода, фторида калия. Определите: а) вид химической связи; б) тип кристаллической решётки; в) физические свойства.
2. В чём сходство и различия в строении атомов галогенов?
3. Определите степени окисления элементов в следующих соединениях: Cl2O; HClO; Cl2O7; HClO4; KClO3; F2O; HBr; I2; Na5IO6. Объясните причину многообразия степени окисления у хлора, брома и иода.
4. Каким образом в растворе иодида калия можно обнаружить присутствие свободного иода?
5. В лаборатории хлор получают взаимодействием концентрированной соляной кислоты и оксида марганца (IV): HCl + MnO2 ⟶ Cl2 + MnCl2 + H2O. Расставьте коэффициенты в уравнении этой реакции, укажите окислитель и восстановитель и рассчитайте объём выделившегося хлора при вступлении в реакцию 3 моль оксида марганца (IV).
6. Для отбеливания тканей и бумаги К. Бертолле в 1788 г. впервые применил “жавелевую воду”, которая образуется при пропускании хлора через холодный раствор щёлочи. Составьте уравнение этой реакции. За основу возьмите реакцию хлора с водой.
7. Ca (ClO)2 – гипохлорит кальция – входит в состав хлорной извести, используемой в качестве дезинфицирующего средства. Эту соль получают взаимодействием хлора с гидроксидом кальция. Запишите уравнение химической реакции.
8. Составьте схему применения хлора. Обсудите её с товарищем.
Глава 5. Галогены.
§17. Строение атомов галогенов. Галогены – простые вещества.
Вопрос в начале параграфа
Назовите элементы, образующие семейство галогенов. Дайте характеристику семейству галогенов.
Задание
Используя знания о галогенах, заполните таблицу. Результаты работы обсудите с товарищем.
Запишите формулы молекул галогенов. Определите вид химической связи в молекулах.
Лабораторный опыт
1. В пробирку со свежеприготовленной хлорной водой опустите синюю лакмусовую бумажку и предварительно окрашенную фиолетовыми чернилами хлопчатобумажную тряпочку. Наблюдайте, что произойдет. Сделайте вывод.
2. Прилейте к растворам бромида и иодида калия хлорную воду, а к раствору иодида калия – бромную воду. Что наблюдаете? Как обнаруживаются свободный бром и иод?
Вопросы в конце параграфа
1. Напишите химические формулы веществ: фтора, фтороводорода, фторида калия. Определите: а) вид химической связи; б) тип кристаллической решётки; в) физические свойства.
2. В чём сходство и различия в строении атомов галогенов?
3. Определите степени окисления элементов в следующих соединениях: Cl2O; HClO; Cl2O7; HClO4; KClO3; F2O; HBr; I2; Na5IO6. Объясните причину многообразия степени окисления у хлора, брома и иода.
4. Каким образом в растворе иодида калия можно обнаружить присутствие свободного иода?
5. В лаборатории хлор получают взаимодействием концентрированной соляной кислоты и оксида марганца (IV): HCl + MnO2 ⟶ Cl2 + MnCl2 + H2O. Расставьте коэффициенты в уравнении этой реакции, укажите окислитель и восстановитель и рассчитайте объём выделившегося хлора при вступлении в реакцию 3 моль оксида марганца (IV).
6. Для отбеливания тканей и бумаги К. Бертолле в 1788 г. впервые применил “жавелевую воду”, которая образуется при пропускании хлора через холодный раствор щёлочи. Составьте уравнение этой реакции. За основу возьмите реакцию хлора с водой.
7. Ca (ClO)2 – гипохлорит кальция – входит в состав хлорной извести, используемой в качестве дезинфицирующего средства. Эту соль получают взаимодействием хлора с гидроксидом кальция. Запишите уравнение химической реакции.
8. Составьте схему применения хлора. Обсудите её с товарищем.
Выберите параграф
§1§2§3§4§5§6§7§8§9§10§11§12§13§14§15§16§17§18§19§20§21§22§23§24§25§26§27§28§29§30§31§32§33§34§35§36§37§38§39§40§41§42§43§44§45§46§47§48§49§50§51§52§53§54§55§56§57
Практические работы
Творческие задания
