

Рассмотрим ответы на Практическая работа 1 из учебника по химии для 9 класса Кузнецовой
Практическая работа №1. Влияние различных факторов на скорость
химической реакции.
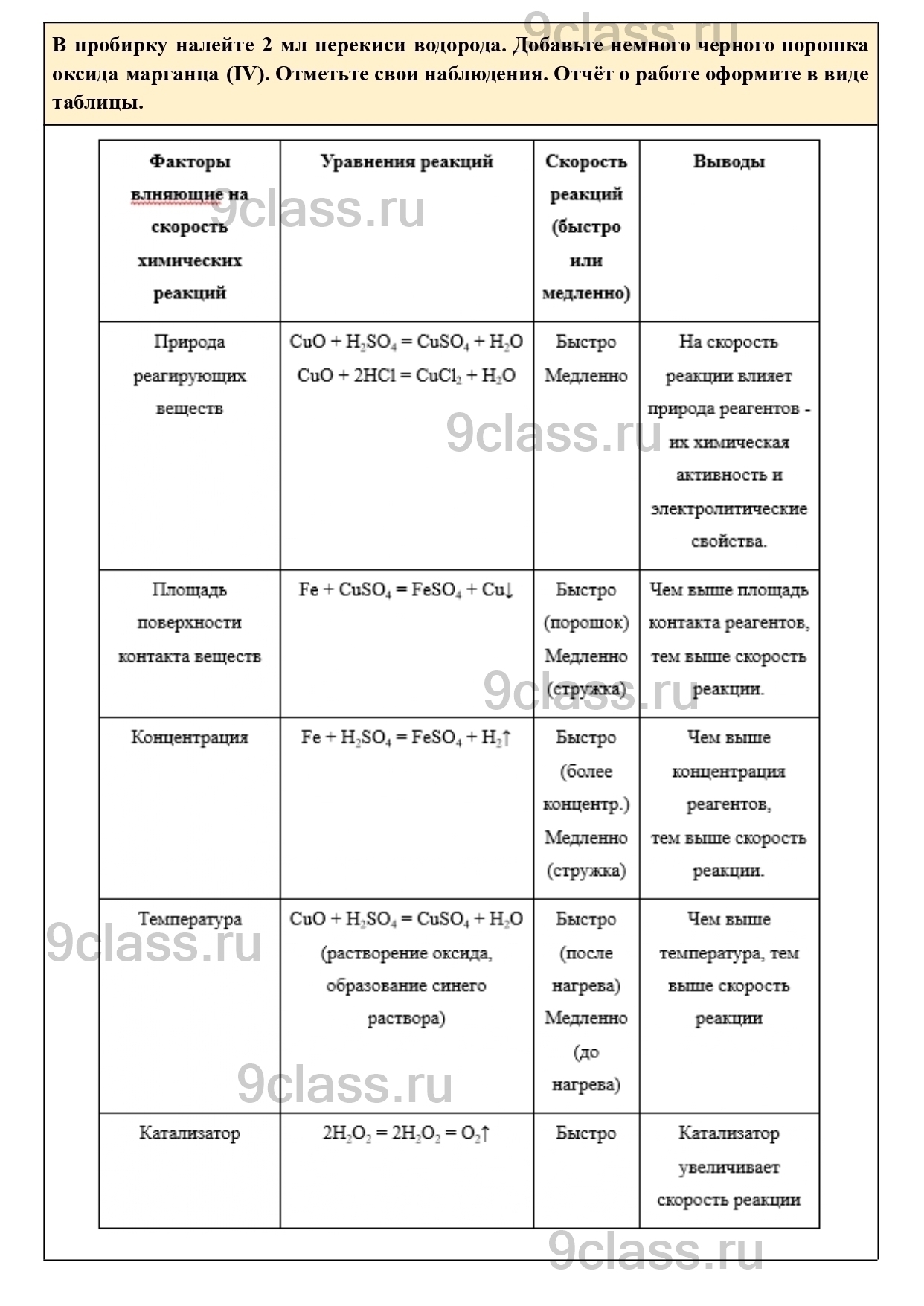
1. Природа реагирующих веществ (состав и строение)
а) В две пробирки поместите немного чёрного порошка оксида меди (II). В первую пробирку добавьте 1 мл серной кислоты, а во вторую – 1 мл соляной кислоты. Наблюдайте признаки химической реакции. В какой из пробирок она протекает быстрее?
б) В одной пробирке смешайте твердые кристаллические соли: сульфат натрия и хлорид бария. В другой пробирке смешайте растворы этих солей. Отметьте свои наблюдения.
2. Площадь поверхности соприкосновения (контакта) веществ
а) В одну пробирку поместите железную кнопку или стружку, а в другую – порошок железа. Добавьте в каждую пробирку по 1 мл раствора сульфата меди (медного купороса). Через некоторое время наблюдайте произошедшие изменения.
б) В одну пробирку поместите кусочек мрамора, а в другую – мраморный порошок. Добавьте в каждую из пробирок по 1 мл соляной кислоты. Что наблюдаете?
3. Концентрация
В две пробирки поместите по одинаковому кусочку железной стружки или по одной грануле железа. В первую пробирку добавьте 1 мл разбавленной серной кислоты, а во вторую – 1 мл концентрированной серной кислоты. В какой пробирке реакция протекает быстрее?
4. Температура
а) В пробирку поместите немного чёрного порошка оксида меди (II) и добавьте 1 мл разбавленной серной кислоты. Отметьте наблюдения. Затем пробирку немного нагрейте на пламени спиртовки (или в электронагревателе для пробирок). Что изменилось? Почему?
б) Получите гидроксид меди (II). Для этого в пробирку с 2 мл раствора сульфата меди добавьте (по каплям!) раствор щелочи. Гидроксид меди (II) – студенистый осадок голубого цвета. Нагрейте его на пламени спиртовки (или в электронагревателе для пробирок). Отметьте признак реакции.
5. Катализатор
В пробирку налейте 2 мл перекиси водорода. Добавьте немного черного порошка оксида марганца (IV). Отметьте свои наблюдения. Отчёт о работе оформите в виде таблицы.
Практическая работа №1. Влияние различных факторов на скорость
химической реакции.
1. Природа реагирующих веществ (состав и строение)
а) В две пробирки поместите немного чёрного порошка оксида меди (II). В первую пробирку добавьте 1 мл серной кислоты, а во вторую – 1 мл соляной кислоты. Наблюдайте признаки химической реакции. В какой из пробирок она протекает быстрее?
б) В одной пробирке смешайте твердые кристаллические соли: сульфат натрия и хлорид бария. В другой пробирке смешайте растворы этих солей. Отметьте свои наблюдения.
2. Площадь поверхности соприкосновения (контакта) веществ
а) В одну пробирку поместите железную кнопку или стружку, а в другую – порошок железа. Добавьте в каждую пробирку по 1 мл раствора сульфата меди (медного купороса). Через некоторое время наблюдайте произошедшие изменения.
б) В одну пробирку поместите кусочек мрамора, а в другую – мраморный порошок. Добавьте в каждую из пробирок по 1 мл соляной кислоты. Что наблюдаете?
3. Концентрация
В две пробирки поместите по одинаковому кусочку железной стружки или по одной грануле железа. В первую пробирку добавьте 1 мл разбавленной серной кислоты, а во вторую – 1 мл концентрированной серной кислоты. В какой пробирке реакция протекает быстрее?
4. Температура
а) В пробирку поместите немного чёрного порошка оксида меди (II) и добавьте 1 мл разбавленной серной кислоты. Отметьте наблюдения. Затем пробирку немного нагрейте на пламени спиртовки (или в электронагревателе для пробирок). Что изменилось? Почему?
б) Получите гидроксид меди (II). Для этого в пробирку с 2 мл раствора сульфата меди добавьте (по каплям!) раствор щелочи. Гидроксид меди (II) – студенистый осадок голубого цвета. Нагрейте его на пламени спиртовки (или в электронагревателе для пробирок). Отметьте признак реакции.
5. Катализатор
В пробирку налейте 2 мл перекиси водорода. Добавьте немного черного порошка оксида марганца (IV). Отметьте свои наблюдения. Отчёт о работе оформите в виде таблицы.
Выберите параграф
§1§2§3§4§5§6§7§8§9§10§11§12§13§14§15§16§17§18§19§20§21§22§23§24§25§26§27§28§29§30§31§32§33§34§35§36§37§38§39§40§41§42§43§44§45§46§47§48§49§50§51§52§53§54§55§56§57
Практические работы
Творческие задания
